
编者按
噬菌体在微生物组工程中展现出巨大的应用潜力,但在多成员群落和动物宿主的研究中,噬菌体的传播动态研究仍面临很多技术挑战。
今天,我们分享由加州大学尔湾分校(UCI)发表在Nature Microbiology的题为“Phollow reveals in situ phage transmission dynamics in the zebrafish gut microbiome at single-virion resolution”的一项最新研究成果。该研究开发了一种荧光标记与活体成像结合技术——Phollow,并利用斑马鱼模型,首次可视化了噬菌体在斑马鱼肠道内的爆发过程。体外细胞病毒学研究表明,噬菌体颗粒在细菌裂解时分散成云状,从而快速传播。研究发现,斑马鱼肠道内的邻单胞菌株(Plesiomonas)的噬菌体颗粒能快速扩散至肝脏和大脑,而大肠杆菌噬菌体则无此能力;抗生素可引发细菌间噬菌体的传播,并导致肠道菌群失调。
Phollow技术能以单病毒颗粒分辨率原位追踪噬菌体的复制与传播,通过在新感染细胞内组装噬菌体时,以不同荧光蛋白标记病毒粒子,实现细菌间噬菌体的精准传播,为多角度研究噬菌体传播及跨界相互作用提供了强大工具,也为基于噬菌体的微生物组疗法开辟了新的路径。
文章题目
Phollow reveals in situ phage transmission dynamics in the zebrafish gut microbiome at single-virion resolution
杂志:Nature Microbiology(IF=20.5)
发表时间:2025年4月18日
作者:Lizett Ortiz de Ora, Elizabeth T. Wiles, Dequina A. Nicholas,Travis J. Wiles等
单位:加州大学尔湾分校(UCI)等
01、研究亮点
• 开发了一种活体成像技术——Phollow,首次实现以单病毒颗粒分辨率在复杂微生物组和斑马鱼中实时追踪噬菌体的复制与传播,发现了不同来源的菌体行为差异及抗生素对其的影响;
• 利用斑马鱼模型构建了两种细菌组成的群落,直接观察斑马鱼肠道内噬菌体的动态爆发及其与宿主组织的相互作用,绘制了斑马鱼肠道内噬菌体复制的动态图谱;
• 利用蛋白标记系统,在噬菌体衣壳上嵌入不同荧光蛋白,通过颜色变化追踪跨细菌宿主的传播链,体外追踪细菌间噬菌体传播,发现噬菌体在不同细胞间传播,导致群落组成发生变化。
02、研究背景
噬菌体(Phage),又称细菌噬菌体,是一类攻击细菌的病毒。作为地球上数量最庞大的生物实体,噬菌体对微生物群落具有深远影响。尽管噬菌体被视为“细菌的致命捕食者”,但它们也可以通过介导遗传物质转移来增强细菌的适应性。阐明噬菌体如何塑造微生物群落的结构与功能,可以为改善人类和环境健康提供新思路。例如,通过控制噬菌体爆发,可以清除致病菌或促进有益菌的传播。然而,想要利用噬菌体清除或调控细菌群落,仍需深入理解噬菌体复制的动态机制。
裂解复制(lytic replication)是一种显性拮抗的水平传播方式。噬菌体侵入细菌并劫取其细胞机制以产生新病毒颗粒,最终通过宿主裂解死亡释放子代病毒。相反,溶原复制(lysogenic replication)则是一种垂直传播形式,常与互利共生相关,噬菌体基因组以整合或游离原噬菌体形式存在,随宿主染色体同步复制。具备溶原能力的噬菌体称为温和噬菌体(temperate phages)。
噬菌体复制模式可作为调控菌群的重要靶点,然而,原位调控噬菌体复制与传播的关键因素尚不明确,尤其在人类胃肠道中,许多问题尚未解答:溶原性复制爆发是局部还是全局性事件?它们是在快速还是短时间内发生的?噬菌体复制动态如何影响菌群生态及宿主的细胞与组织?由于传统方法缺乏时空敏感性及可扩展的分辨率,这些问题很多仍有待进一步探究。若无法阐明噬菌体复制的时空特征,如噬菌体是以胞外病毒颗粒还是细胞内原噬菌体的形式存在等,则难以构建肠道内噬菌体生物学的系统性认知。
为此,研究人员开发了一套基于活体成像的原位监测噬菌体爆发的工具与技术——Phollow,突破现有技术限制,并结合斑马鱼模型,通过16组独立实验、超 500次成像分析及300尾斑马鱼样本,首次实现以单病毒颗粒分辨率在复杂微生物组和斑马鱼中实时追踪噬菌体的复制与传播,展现了 “技术开发 - 机制解析 - 应用探索” 的研究范式,为研究微生物群落和斑马鱼肠道内的噬菌体传播动态提供了新的解决思路。
03、斑马鱼研究结果
1. 构建Phollow用于噬菌体的感染性验证
研究人员选择P2类噬菌体来进行可视化噬菌体复制机制研究,并开发了一种体内标记系统,噬菌体病毒颗粒在宿主细胞内组装时被荧光标记,但在感染新宿主细菌并复制后,会通过不同颜色的荧光标记进行示踪。这种新的组合标记策略,命名为“Phollow”,使得追踪噬菌体爆发期间的跨细菌传播成为可能。
研究人员利用SpyTag/SpyCatcher标记系统构建了Phollow,对噬菌体进行荧光标记(图1a)。对大肠杆菌HS菌株中携带的P2类原噬菌体DuoHS的主要衣壳蛋白(GpN)进行改造,在其C端添加肽接头和SpyTag。随后,通过Tn7转座子,将与不同荧光蛋白融合的SpyCatcher组成型表达基因插入细菌染色体。在噬菌体衣壳组装过程中,衣壳上的SpyTag与SpyCatcher蛋白共价结合,从而生成荧光标记的Phollow噬菌体(图1a)。
在裂解复制期间,SpyCatcher蛋白从细菌胞质重新分布至正在组装的Phollow噬菌体衣壳(图1b)。宿主裂解后,荧光标记的Phollow噬菌体颗粒向环境扩散(图1b)。感染不同标记的宿主后,Phollow噬菌体将携带新的荧光标签,可实现跨细菌传播的追踪(图1c)。Phollow噬菌体与未荧光标记的野生型噬菌体具有相似的感染性,表明其能够精确模拟天然复制与传播过程(图1d)。
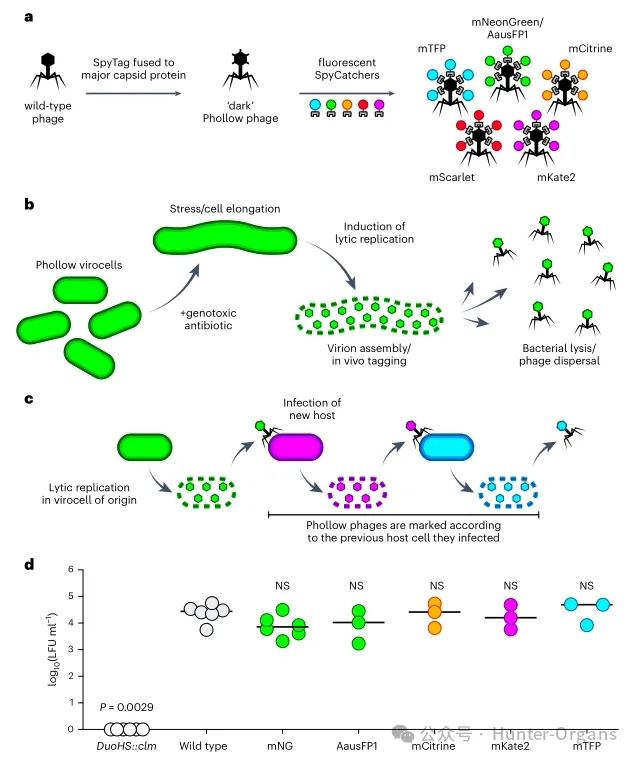
图1
2. 在斑马鱼肠道内可视化观察噬菌体的爆发
研究人员进一步将Phollow技术与斑马鱼模型结合,实现了斑马鱼肠道内微生物群落的直接观测(图2a)。通过将大肠杆菌Phollow病毒细胞定植于无菌斑马鱼肠道,并利用甲氧苄啶诱导裂解复制(图2b),观察到:给药4h内,病毒颗粒云从食管至远端肠道全面爆发(图2c,d)。裂解活动呈急性特征,8h后逐渐消退,24h后几乎无残留。值得注意的是,未处理组虽多数无病毒颗粒,但偶见自发裂解现象(图2c)。
甲氧苄啶诱导的肠道裂解伴随着病毒颗粒向外部的释放(图2e),活体成像显示的噬菌体爆发模式与感染性病毒颗粒数量的波动高度一致:诱导后4h,处理组溶原形成单位(LFUs)显著高于对照组(图2f);24h后恢复基线。
进一步探究不同宿主来源的噬菌体是否具有类似行为,从斑马鱼肠道分离的邻单胞菌株(Plesiomonas)中鉴定出功能性P2类原噬菌体DuoZ11。其Phollow病毒细胞展现出与大肠杆菌相似的胞内组装与胞外扩散模式。按图2b方案诱导后,邻单胞菌株(Plesiomonas)噬菌体同样在肠道内形成病毒云(图2g)。然而,DuoZ11噬菌体颗粒被肠道内壁细胞快速内化,其中一类为通过转基因斑马鱼确认的肠内分泌细胞(EECs)(图2h)。
此外,邻单胞菌株(Plesiomonas)来源的病毒颗粒可迅速从肠道播散至肝脑等肠外器官,其在肝脏中以脂滴样结构聚集(图2i),在脑部血管中与血细胞表面结合(图2j)。通过对照实验,排除了非特异性荧光信号的干扰,证实EECs及肠外组织的信号确为病毒颗粒。与大肠杆菌噬菌体类似,邻单胞菌株(Plesiomonas)病毒在24h后从肠道及肠外组织完全清除。
综上,Phollow技术揭示了不同宿主来源的P2类噬菌体既存在共性特征,如快速扩散与清除等,又表现出噬菌体/菌株的独特依赖性。
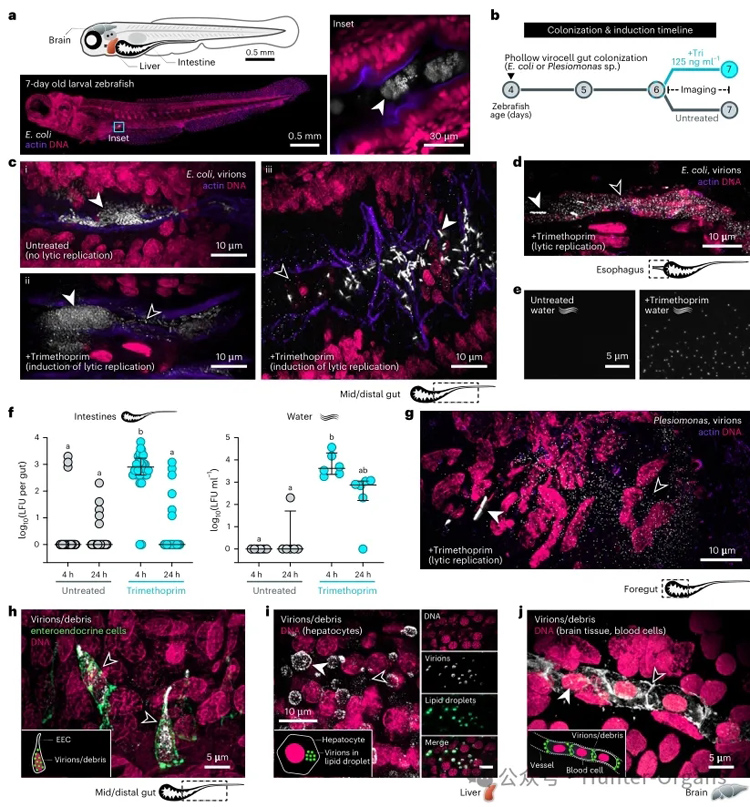
图2
3. 斑马鱼肠道内噬菌体复制的传播动态分析
随后,为追踪斑马鱼肠道内噬菌体的传播动态,研究人员将标记的大肠杆菌Phollow病毒细胞与mKate2靶细胞组成的双菌群定植于无菌斑马鱼肠道(图3a)。诱导前,AausFP1病毒细胞表现出对mKate2靶细胞的定殖优势(图3b“未处理”),呈现强烈的空间隔离,形成克隆簇镶嵌结构(图3c上),与斑马鱼肠道菌群的既往观察一致。
甲氧苄啶处理后2h检测到AausFP1病毒细胞的裂解活动,但随后菌群空间结构迅速重构(图3c);4h后,菌群出现显著的空间混合,且该现象主要由噬菌体裂解爆发驱动,而非抗生素单独作用。尽管此时相对丰度均未明显改变,且mKate2靶细胞未发生溶原化(图3b),但仅有AausFP1病毒颗粒排泄至水体(图3d),提示细菌间传播尚未发生。
24h后,肠道内虽无病毒残留,但菌群空间结构近乎恢复至处理前状态(图3e)。群落组成分析显示通过溶原化形成,mKate2病毒细胞出现(图3b),表明在4-24h间发生了AausFP1噬菌体的水平传播。二次诱导后,菌群再次出现空间解构(图3e下),且水体中同时检出AausFP1和mKate2噬菌体(图3f),表明后者源自第一波裂解中形成的mKate2病毒细胞。
综上,Phollow技术揭示了肠道菌群空间组织与噬菌体扩散/传播间的动态耦合关系。
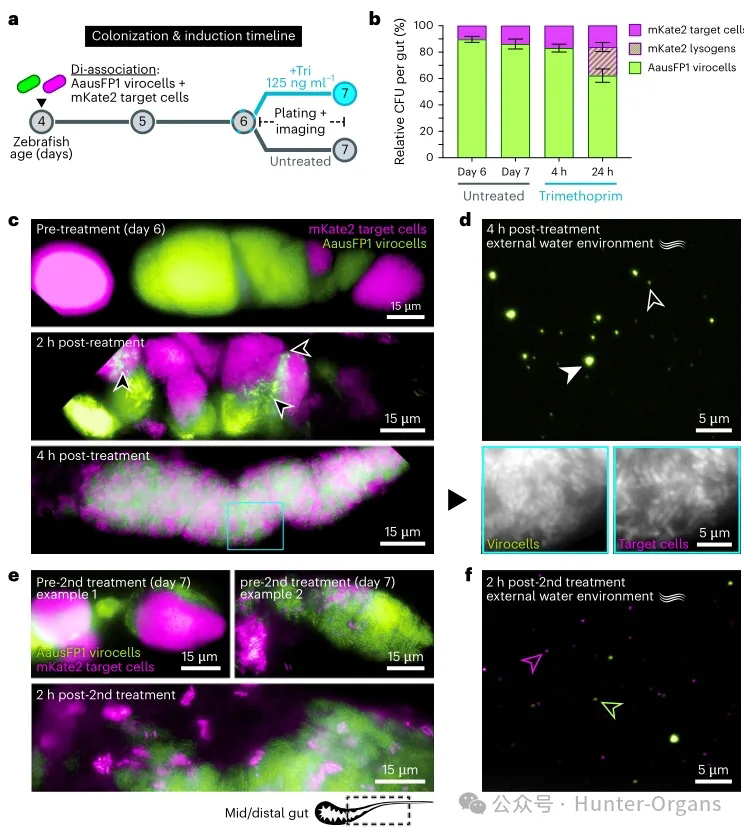
图3
04、编者点评
本研究开发了一种新型遗传工具与技术——Phollow,实现了噬菌体裂解复制与传播的原位研究。研究表明,Phollow噬菌体可同时兼容活体成像与流式病毒测定技术,为解析噬菌体爆发的流行病学特征提供了新实验范式。研究人员还将Phollow与斑马鱼模型结合,观察到噬菌体在脊椎动物肠道内的爆发,为噬菌体传播及跨界相互作用的多尺度研究提供了强大的工具,有望为基于噬菌体的微生物组疗法开辟新的途径。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
